Forschende verstehen die Müllabfuhr unserer Zellen besser – und können sie steuern
Freiburg, 07.01.2024
Ein Forschungsteam aus Freiburg und Frankfurt hat herausgefunden, wie Zellen Abfall in ihrem Inneren erkennen und abbauen. Ergebnisse sind relevant für Therapieentwicklungen bei Erkrankungen wie Alzheimer.
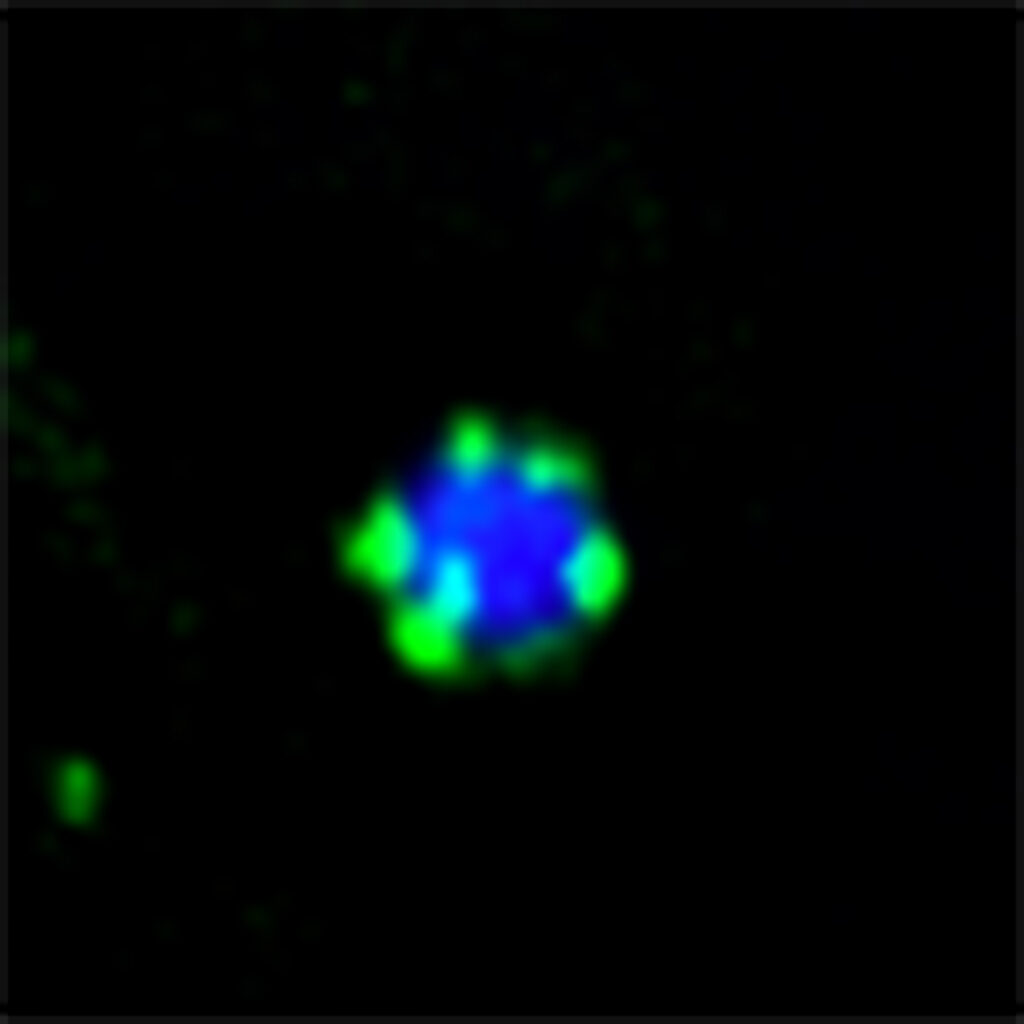
Unter dem Fluoreszenzmikroskop: Das Molekül Atg11 (grün) bildet kleine Tröpfchen auf der Oberfläche eines Protein-Aggregats (blau). Bild: Mariya Licheva / Universität Freiburg
Auch in unseren Zellen findet Recycling statt: Bei der so genannten Autophagie werden nicht mehr benötigte Zellbestandteile von Membranen umschlossen und in ihre Grundbausteine zerlegt. Dieser lebenswichtige Prozess verhindert die Bildung schädlicher Aggregate und macht Nährstoffe wieder verfügbar. Ein Forschungsteam unter der gemeinsamen Leitung von Prof. Dr. Claudine Kraft vom Exzellenzcluster CIBSS der Universität Freiburg und Dr. Florian Wilfling vom Max-Planck-Institut für Biophysik in Frankfurt hat jetzt herausgefunden, welche Bedingungen notwendig sind, damit Autophagie startet. Es gelang ihnen auch, diese Bedingungen künstlich zu erzeugen und so den Abbau von sonst nicht-abbaubaren Molekülen in Hefezellen auszulösen. Ein solches gezieltes Eingreifen in Autophagie-Prozesse ist ein vielversprechender Ansatz, um den Abbau von Aggregaten zu fördern, die ansonsten Plaques bei neurodegenerativen Erkrankungen wie Alzheimer bilden können, oder um die Wirksamkeit von Krebstherapien zu unterstützen. Die Studie ist in der Fachzeitschrift Nature Cell Biology erschienen.
Schwache Molekül-Wechselwirkungen notwendig für Beginn der Autophagie
Damit Zellbestandteile durch Autophagie abgebaut werden können, müssen sie in einem ersten Schritt als Abfall erkannt werden. Das geschieht durch Rezeptor- und weitere Adapter-Moleküle. Wie genau diese die weiteren Schritte auslösen, war bisher aber nicht bekannt. „Wir konnten jetzt zeigen, dass die Rezeptoren schwach an das zu entsorgende Material binden müssen, damit die Autophagie startet“, erklärt Kraft. „Binden sie zu stark, wird der Prozess nicht ausgelöst.“
Was zunächst kontraintuitiv klingt, konnten die Forschenden mithilfe von Computersimulationen und Experimenten an lebenden Hefezellen und menschlichen Zellen in Zellkultur erklären: Die schwache Bindung führt dazu, dass die Rezeptoren beweglich bleiben und zufällige Ansammlungen bilden. „Ist an einer Stelle eine kritische Konzentration erreicht, kommt es zu einer Phasenseparierung: Die Adapter-Moleküle finden sich zusammen und bilden einen Tropfen, ähnlich wie Öl in Wasser“, erklärt Wilfling. „Eine solche flüssige Ansammlung hat andere physikalische Eigenschaften als einzelne Moleküle und dient als flexible Plattform für alle weiteren an der Autophagie beteiligten Moleküle.“
Prozess künstlich steuerbar
Um ihre Hypothese zu prüfen, brachten die Forschenden Viruspartikel in Hefezellen ein, die die Zellen normalerweise nicht abbauen können. Indem sie die Viruspartikel so veränderten, dass Autophagie-Rezeptoren schwach daran binden konnten, gelang es den Forschenden, den Abbau des störenden Virus auszulösen. Veränderten sie die Oberfläche jedoch so, dass die Rezeptoren stark daran banden, fand kein Abbau statt. „Das ist ein vielversprechendes Ergebnis, denn es zeigt, dass wir gezielt in die Autophagie lebender Zellen eingreifen können“, fassen Kraft und Wilfling zusammen.
Faktenübersicht
- Originalpublikation: Mariya Licheva, Jeremy Pflaum, Riccardo Babic, Hector Mancilla, Jana Elsässer, Emily Boyle, David M Hollenstein, Jorge Jimenez, Jonas Pleyer, Mio Heinrich, Franz-Georg Wieland, Joachim Brenneisen, Christopher Eickhorst, Johann Brenner, Shan Jiang, Markus Hartl, Sonja Welsch, Carola Hunte, Jens Timmer, Florian Wilfling, Claudine Kraft (2024). Phase separation of initiation hubs on cargo is a trigger switch for selective autophagy. In: Nature Cell Biology. DOI: 10.1038/s41556-024-01572-y
- Prof. Dr. Claudine Kraft forscht am Institut für Biochemie und Molekulare Biologie der Universität Freiburg und ist Mitglied des Exzellenzclusters CIBSS – Centre for Integrative Biological Signalling Studies. Dr. Florian Wilfling forscht am Max-Planck-Institut für Biophysik in Frankfurt am Main.
- Die Studie wurde gefördert durch die Deutsche Forschungsgemeinschaft (EXC-2189; SFB 1381; SFB 1177; 450216812; 409673687; GRK 2606;) durch den Europäischen Forschungsrat im Rahmen des Horizon 2020 Programms (ERC 769065), die Max-Planck-Gesellschaft und durch die Europäische Union (ERC 101041982).